股价跌超60%!Rocket基因疗法致患者死亡,FDA紧急叫停
因一名患者死于严重并发症,美国食品药品管理局(FDA)宣布暂停了生物制药公司Rocket Pharma的Danon病基因疗法关键2期临床试验。
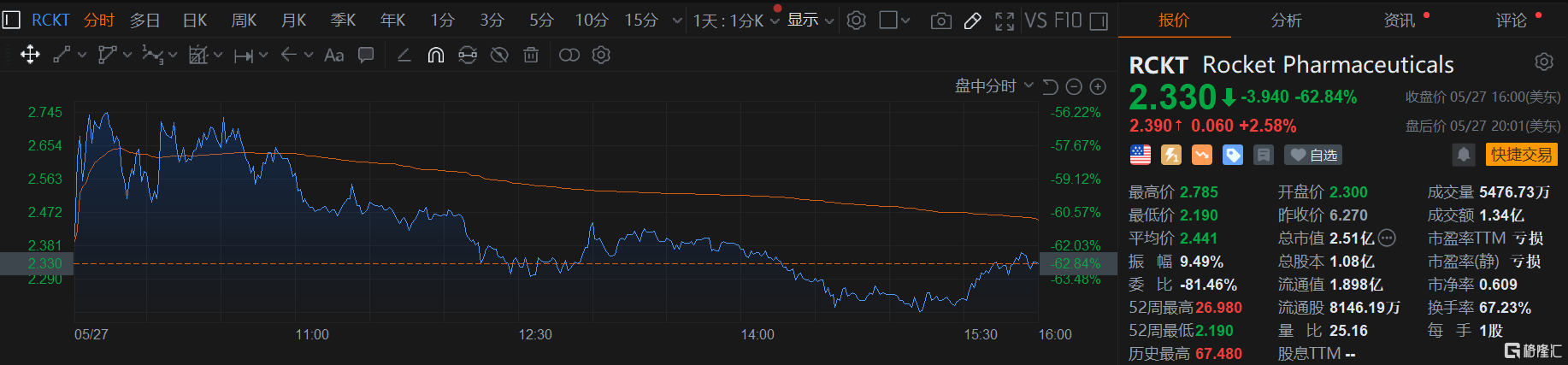
受此消息影响,周二Rocket股价出现断崖式下跌,较前一交易日跌超62%,今年迄今股价累计下跌超80%。
患者死亡,试验紧急叫停
5月27日,Rocket Pharmaceuticals公司(以下简称“Rocket”)宣布其针对Danon病(一种溶酶体糖原贮积病)的在研基因疗法RP-A501的Ⅱ期关键性临床试验中出现一例严重不良事件(SAE),一名患者在治疗过程中因毛细血管渗漏综合征相关并发症导致急性感染,最终死亡。
Rocket已暂停试验给药,FDA于上周五(5月23日)正式下达临床试验限制令,要求进一步评估事件原因。
公司正在调查死因,初步怀疑与新引入的免疫抑制剂(C3抑制剂)有关,该药物旨在减轻部分患者出现的补体激活反应。

Rocket公司正在与FDA、独立数据安全监测委员会、临床研究人员和科学专家合作,致力于确保所有研究患者的安全,同时尽快恢复试验。由于临床暂停状态仍未解除,公司无法就II期试验的预计完成时间提供指导。
Rocket首席执行官Gaurav Shah博士表示:“我们对这一损失深感悲痛,但我们仍将全力以赴地致力于开发基因疗法,以解决像Danon病等严重疾病的根本原因。我们对所有参与这项重要研究的患者及其家属深表感激。”
公司强调,其余临床项目——PKP2与BAG3相关的基因疗法研发未受本次临床暂停影响,仍在按计划推进。
市场信心仍存但观望情绪浓重
近几个月来,其他公司的临床试验中也出现了患者死亡事件,包括Sarepta Therapeutics的杜氏肌营养不良症基因疗法Elevidys、Neurogene的Rett综合征第1/2期研究,以及Beam Therapeutics的镰状细胞病疗法BEAM-101。
行业分析师对这些事件的长期影响意见不一。
Jefferies分析师认为,这次死亡事件"损害了Danon项目的效益/风险状况",并强化了基因疗法严重毒性不可预测的观点,可能会打击该领域的投资。
相反,BMO Capital Markets保持更乐观的看法,称尽管出现患者死亡,但考虑到Danon病患者通常预后不良,RP-A501的效益/风险状况可能仍然合理。
分析师估计,Rocket Pharmaceuticals的季度现金消耗为4000万至5000万美元,预计临床叫停将给公司的财务状况带来压力。
不过,Rocket报告称,第一季度末现金、现金等价物和投资总额为3.182亿美元。预计现有资源足以支持到2027年的运营,不包括血液学产品组合中某些疗法获批后可能出售优先审评券的任何潜在收益。
交易商排行
更多- 监管中EXNESS10-15年 | 英国监管 | 塞浦路斯监管 | 南非监管89.22
- 监管中VSTAR塞浦路斯监管| 直通牌照(STP)80.00
- 监管中FXTM 富拓10-15年 |塞浦路斯监管 | 英国监管 | 毛里求斯监管85.21
- 监管中axi15-20年 | 澳大利亚监管 | 英国监管 | 新西兰监管85.00
- 监管中GoldenGroup高地集团澳大利亚| 5-10年85.87
- 监管中Moneta Markets亿汇澳大利亚| 2-5年| 零售外汇牌照75.97
- 监管中GTCFX10-15年 | 阿联酋监管 | 毛里求斯监管 | 瓦努阿图监管63.65
- 监管中IC Markets10-15年 | 澳大利亚监管 | 塞浦路斯监管91.81
- 监管中markets4you毛里求斯监管| 零售外汇牌照| 主标MT4| 全球展业|82.31
- 监管中CPT Markets Limited5-10年 | 英国监管 | 伯利兹监管92.61


